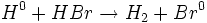|
|
شکافت ، نمونهای از واکنشهای زنجیری
|
| واکنشی را که دارای چندین مرحله است و در هر مرحله آن یک جسم واکنش پذیر بوجود میآید که موجب اجرا شدن مرحله بعدی میشود، واکنش زنجیری مینامند. گرچه ممکن است واکنشهای زنجیری در جزئیات با یکدیگر تفاوتهای زیادی داشته باشند، همگی در بعضی ویژگیهای اساسی وجه مشترک دارند. |
کلراسیون متان ، یک واکنش زنجیری
مرحله آغاز زنجیر
نخستین مرحله در واکنشهای زنجیری ، مرحله آغاز زنجیر است که در آن ، انرژی جذب میشود و یک ذره واکنش پذیر بوجود میآید. این مرحله ، در واکنش کلراسیون متان ، گسستن مولکول کلر به اتمهای کلر است.
گرما یا نور
مرحله انتشار زنجیر
چند مرحله انشتار زنجیر وجود دارد در هر یک از این مراحل ، یک ذره واکنش پذیر مصرف میشود و ذرهای دیگر بوجود میآید، در واکنش کلراسیون متان ، این مراحل عبارتند از واکنشهای اتمهای کلر با متان:
و واکنش رادیکالهای متیل به مولکول کلر:
مرحله پایان زنجیر
سرانجام مراحل پایان زنجیر وجود دارند. در این مراحل ، ذرات واکنش پذیر مصرف میشوند، ولی بوجود نمیآیند. در کلراسیون متان ، این مراحل شامل اتحاد دو ذره واکنش پذیر یا جذب یکی از آنها بوسیله دیوارههای ظرف واکنش است.
>
در شرایط معین به ازای هر
کوانتوم نور (فوتون) جذب شده ، در حدود 10000 مولکول متیل کلرید تشکیل میشود. هر فوتون موجب گسستن یک مولکول کلر به دو اتم کلر میشود و هر اتم کلر یک زنجیر آغاز میکند، بطور میانگین هر زنجیر پیش از آنکه در نهایت پایان پذیرد، در چرخه انتشار زنجیر 5000 بار تکرار میشود.
واکنش گاز 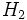 و گاز
و گاز 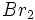
واکنش بین گاز و بخار
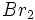
، در
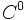
200 نمونهای دیگر از واکنش زنجیری است. میتوان مراحل این نوع واکنش را بصورت زیر نشان داد:
- مرحله آغاز زنجیر: برخی از مولکولهای
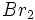 به اتمهای آن تفکیک می شود:
به اتمهای آن تفکیک می شود:
- مرحله انتشار زنجیر: رادیکالهای
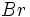 ، واسطهای فعالی هستند که پیشبرندههای زنجیر نامیده میشوند. یک رادیکال Br با یک مولکول
، واسطهای فعالی هستند که پیشبرندههای زنجیر نامیده میشوند. یک رادیکال Br با یک مولکول 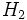 ترکیب میشود:
ترکیب میشود:
در این واکنش ، یک مولکول محصول
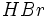
، و یک پیشبرنده دیگر ، یک اتم
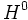
(رادیکال) ، تولید میشود. رادیکال
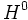
با مولکول
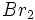
ترکیب میشود:
در این واکنش یک مولکول دیگر
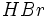
و یک رادیکال
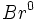
که پیشبرنده اصلی زنجیر است، تولید میشود. اتم
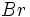
با یک مولکول دیگر
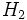
ترکیب میشود و این چرخه مجددا آغاز می گردد. این دو مرحله ، چندین بار تکرار میشود.
- مرحله بازداری زنجیر: با برخورد یک رادیکال
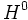 با یک مولکول
با یک مولکول 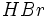 ، واکنشها رخ میدهد که بازدارنده واکنش کل است:
، واکنشها رخ میدهد که بازدارنده واکنش کل است:
چون در این مرحله ، یک مولکول محصول (
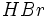
) مصرف شده و یک مولکول واکنش دهنده (
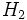
) تولید میگردد، این مرحله واکنش کل را آهسته میکند، ولی موجب گسسته شدن زنجیر یا توقف واکنش نمیشود. زیرا پیشبرنده زنجیر (
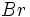
) نیز در این مرحله تولید میشود.
|
|
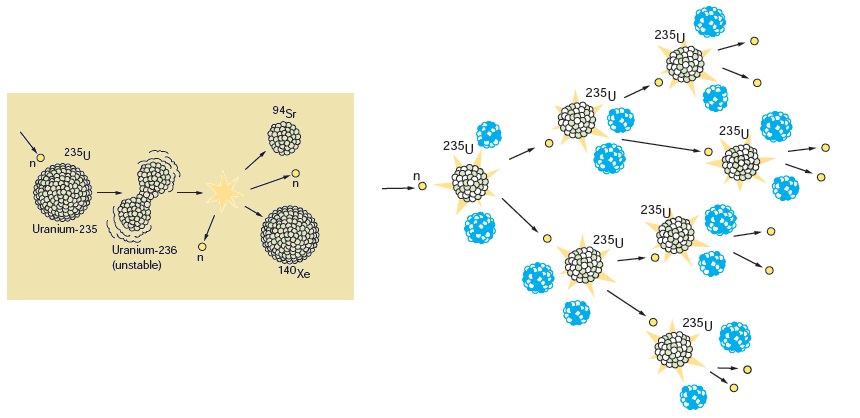
شکافت هستهای
|
- مرحله پایان زنجیر: وقتی دو پیشبرنده بهم میرسند، انتهای دو زنجیر بسته میشود:
باور بر این است که مکانیسم واکنش
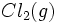
و
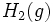
نظیر این مکانیسم باشد مخلوطی از این دو گاز را میتوان در دمای معمولی و در تاریکی به مدت مدیدی نگهداری کرد، بدون اینکه باهم ترکیب شوند. ولی اگر این مخلوط در معرض نور قرار گیرد، واکنشی بسیار سریع صورت میگیرد. باور بر این است که مولکولهای
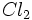
در معرض نور به اتمهای کلر تفکیک شده و واکنش زنجیری را آغاز میکنند. واکنش
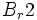
و
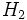
نیز به نور حساسیت دارد ولی این واکنش در دمای معمولی آهستهتر است.
بازدارندههای واکنش زنجیری
هر جسمی که حتی به مقدار کم از سرعت یک واکنش بکاهد و یا آن را متوقف کند، بازدارنده نامیده میشود. مدت زمانی را که در جریان آن عمل بازدارندگی طول میکشد و بعد از آن ، واکنش بطور عادی پیشرفت میکند،
دوره بازداری مینامند. بازداشتن بوسیله مقدار نسبتا" کم از یک ماده افزودنی ، یکی از ویژگیهای انواع واکنشهای زنجیری است و اغلب یکی از سرنخهایی است که در مراحل ابتدایی به ما میگوید با یک واکنش زنجیری سر و کار داریم.
فهمیدن این مطلب که چگونه شمار کمی مولکول میتوانند از واکنش آن همه مولکول جلوگیری کنند، دشوار است. به عنوان مثال مقدار کمی اکسیژن از سرعت واکنش کلراسیون متان برای مدتی ، که به مقدار اکسیژن بستگی دارد، میکاهد و بعد از آن واکنش با سرعت معمولی خود پیش می رود. تصور میرود که اکسیژن با رادیکال متیل میدهد و یک رادیکال جدید بوجود میآورد:
رادیکال
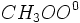
خیلی واکنش ناپذیرتر از رادیکال
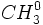
است و برای ادامه زنجیر ، کارآیی چندانی ندارد. وقتی یک مولکول اکسیژن با یک رادیکال متیل ترکیب می شود، یک زنجیر را میشکند و به این ترتیب از تشکیل شدن هزاران مولکول متیل کلرید جلوگیری میکند. البته این کار فوقالعاده از
سرعت واکنش میکاهد. بعد از آنکه تمام مولکولهای اکسیژن موجود با رادیکالهای متیل ترکیب شدند، واکنش آزاد است که با سرعت معمولی خود پیشرفت کند.
مباحث مرتبط با عنوان
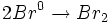
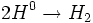
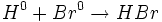
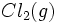 و
و 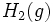 نظیر این مکانیسم باشد مخلوطی از این دو گاز را میتوان در دمای معمولی و در تاریکی به مدت مدیدی نگهداری کرد، بدون اینکه باهم ترکیب شوند. ولی اگر این مخلوط در معرض نور قرار گیرد، واکنشی بسیار سریع صورت میگیرد. باور بر این است که مولکولهای
نظیر این مکانیسم باشد مخلوطی از این دو گاز را میتوان در دمای معمولی و در تاریکی به مدت مدیدی نگهداری کرد، بدون اینکه باهم ترکیب شوند. ولی اگر این مخلوط در معرض نور قرار گیرد، واکنشی بسیار سریع صورت میگیرد. باور بر این است که مولکولهای 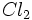 در معرض نور به اتمهای کلر تفکیک شده و واکنش زنجیری را آغاز میکنند. واکنش
در معرض نور به اتمهای کلر تفکیک شده و واکنش زنجیری را آغاز میکنند. واکنش 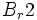 و
و 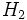 نیز به نور حساسیت دارد ولی این واکنش در دمای معمولی آهستهتر است.
نیز به نور حساسیت دارد ولی این واکنش در دمای معمولی آهستهتر است.
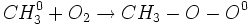
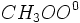 خیلی واکنش ناپذیرتر از رادیکال
خیلی واکنش ناپذیرتر از رادیکال 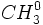 است و برای ادامه زنجیر ، کارآیی چندانی ندارد. وقتی یک مولکول اکسیژن با یک رادیکال متیل ترکیب می شود، یک زنجیر را میشکند و به این ترتیب از تشکیل شدن هزاران مولکول متیل کلرید جلوگیری میکند. البته این کار فوقالعاده از سرعت واکنش میکاهد. بعد از آنکه تمام مولکولهای اکسیژن موجود با رادیکالهای متیل ترکیب شدند، واکنش آزاد است که با سرعت معمولی خود پیشرفت کند.
است و برای ادامه زنجیر ، کارآیی چندانی ندارد. وقتی یک مولکول اکسیژن با یک رادیکال متیل ترکیب می شود، یک زنجیر را میشکند و به این ترتیب از تشکیل شدن هزاران مولکول متیل کلرید جلوگیری میکند. البته این کار فوقالعاده از سرعت واکنش میکاهد. بعد از آنکه تمام مولکولهای اکسیژن موجود با رادیکالهای متیل ترکیب شدند، واکنش آزاد است که با سرعت معمولی خود پیشرفت کند.



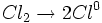
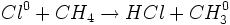
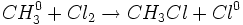
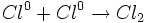
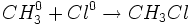
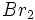
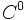 200 نمونهای دیگر از واکنش زنجیری است. میتوان مراحل این نوع واکنش را بصورت زیر نشان داد:
200 نمونهای دیگر از واکنش زنجیری است. میتوان مراحل این نوع واکنش را بصورت زیر نشان داد: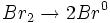
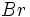 ، واسطهای فعالی هستند که پیشبرندههای زنجیر نامیده میشوند. یک رادیکال
، واسطهای فعالی هستند که پیشبرندههای زنجیر نامیده میشوند. یک رادیکال 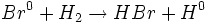
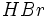 ، و یک پیشبرنده دیگر ، یک اتم
، و یک پیشبرنده دیگر ، یک اتم 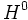 (رادیکال) ، تولید میشود. رادیکال
(رادیکال) ، تولید میشود. رادیکال 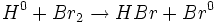
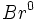 که پیشبرنده اصلی زنجیر است، تولید میشود. اتم
که پیشبرنده اصلی زنجیر است، تولید میشود. اتم