دید کلی
برای بررسی تبدیلات فاز ، باید به بررسی تعادلات فیزیکی و شیمیایی و قوانین فاز بپردازیم. تعادلات فیزیکی و شیمیایی سیستمهای ناهمگن را به وسیله
قانون فاز که کاشف آن «
گیبس » آمریکایی است، تحت مطالعه قرار میدهند. به وسیله آن میتوان دیاگرامهایی رسم و از نظر کیفی پیش بینی کرد که تغییرات عوامل تعادل ،
فشار ، درجه حرارت و
غلظت ، در سیستم در حال تعادل چه تبدیلاتی بوجود میآورد. این قانون که بر آن محدودیتی نمیتوان قائل شد، دامنه بسیار وسیعی دارد که امکان گنجاندن تمام مطالب آن وجود ندارد و فقط تا حدودی که بتوان با مبحث فوق آشنا شد، به آن میپردازیم.
فاز
کلمه
فاز یک واژه یونانی و به معنی
ظاهر است. یک فاز حالتی از ماده است که بطور کامل یکنواخت میباشد، این یکنواختی نه فقط از لحاظ ترکیب شیمیایی است، بلکه شامل
حالت فیزیکی هم میشود. از این رو از فازهای جامد ، مایع و گاز یک ماده و از فازهای جامد مختلف آن ماده (مانند فسفر سیاه و فسفر سفید) سخن به میان میآوریم.
جز
منظور از جز ، گونه موجود در سیستم ، مانند حل شده و حلال در یک سیستم دوتایی میباشد.
تعداد فازها
تعداد فازها در سیستم را با P نشان میدهیم. یک گاز یا یک مخلوط گازی ، یک
بلور و بالاخره دو مایع کاملا امتزاج پذیر همگی فقط یک فاز را تشکیل میدهند. گرچه ممکن است یخ به قطعات کوچکتری خرد شود، ولی فقط یک فاز دارد (P = 1)، محلول آب و یخ سیستم دو فازی میباشد (P = 2)، گرچه مشخص کردن مرز بین این فازها مشکل است. آلیاژی از دو فلز امتزاج یک سیستم دو فازی میباشد (P = 2)، در حالی که اگر امتزاج پذیر باشند، یک سیستم یک فازی است (P = 1). از این مثال استنباط میشود که قضاوت در این مورد که آیا سیستمی یک یا دو فاز دارد، همیشه آسان نیست.
تعداد اجزا
کمترین تعداد گونههای مستقلی که برای مشخص نمودن ترکیب تمام فازها در سیستم لازم است، را
تعداد اجزا مینامیم و آن را با C نمایش میدهیم. اگر گونههای موجود در سیستم ترکیب نشوند، به آسانی میتوان از این تعریف استفاده کرد. برای مثال ، آب خالص سیستم یک جزئی (C = 1) و مخلوط آب –
اتانول سیستم دو جزئی (C = 2) است. اگر گونهها با هم ترکیب شوند و در تعادل قرار گیرند، باید مفهوم تمام فازها در این تعریف را مدنظر داشته باشیم، بنابراین در مورد
کلرید آمونیوم در تعادل با بخارش:
چون هر فاز بطور رسمی ترکیب
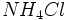
را دارد، سیستم یک جزئی است. اگر
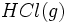
اضافی وارد سیستم کنیم، سیستم دو جز خواهد داشت، زیرا نسبت مقادیر
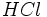
و
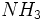
اختیاری میشود. بر عکس ،
کربنات کلسیم در تعادل با بخارش یک سیستم دو جزئی است، زیرا ترکیب فاز بخار به صورت
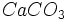
نیست.
قانون فاز
در سیستم یک جزئی (C = 1) اگر فقط یک فاز وجود داشته باشد (P = 1)، فشار و دما میتوانند بطور مستقل تغییر کنند. اگر
واریانس (F) سیستم را به صورت تعداد متغیرهای شدتی تعریف کنیم که میتواند به طور مستقل تغییر کند، بدون آنکه اختلالی در تعداد فازهای در حال تعادل سیستم بنماید، در این صورت
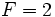
است. به عبارت دیگر ، سیستم ما ،
سیستم دو وردا یا
دو واریانسی میباشد و دو درجه آزادی دارد.
گیبس یکی از برازندهترین محاسبات ترمودینامیکی شیمیایی
قانون فاز را بدست آورد. این قانون ، رابطه کلی بین واریانس (F) و تعداد اجزا (C) و تعداد فازهای در حال تعادل (P) برای سیستمی با هر ترکیبی برقرار میکند:
سیستم یک جزئی
برای سیستم یک جزئی مانند آب خالص چنین داریم:
اگر فقط یک فاز موجود باشد، در این صورت
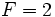
است، یعنی T و P میتواند بطور مستقل تغییر کند. به عبارت دیگر ، یک فاز تنها با یک سطح در
نمودار فاز نشان داده میشود. اگر فقط دو فاز در حال تعادل باشد،
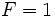
است که در این صورت اگر دما را انتخاب کنیم، فشار به دلخواه تغییر نمیکند. به عبارت دیگر ، تعادل بین دو فاز در نمودار فاز با یک خط نماشی داده میشود. میتوانیم به جای دما ، فشار را انتخاب کنیم، لیکن این کار را باید طوری انجام دهیم که دو فاز در دمای معین به تعادل برسند. بنابراین ،
انجماد (یا هر تبدیل فازی) در یک فشار معین در دمای خاصی اتفاق میافتد.
اگر سه فاز در حال تعادل باشند،
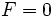
است. این حالت بی واریانس فقط میتواند در شرایط دما و فشار خاصی اتفاق بیافتد. بنابراین تعادل بین سه فاز با یک نقطه به نام
نقطه سه گانه در نمودار فاز نشان داده میشود.
در سیستم یک جزئی ، چهار فاز نمیتواند در تعادل باشد، چون F نمیتواند منفی باشد.
سیستمهای دو جزئی
اگر دو جز در سیستم وجود داشته باشد،
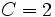
و
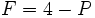
، فشار را جهت سهولت ثابت نگه میداریم (برای مثال در 1atm) تا یک درجه آزادی کنار گذاشته شود. در این صورت رابطه

را برای واریانس باقیمانده مینویسیم. یکی از درجات آزادی باقیمانده ، دماست و دیگری ترکیب سیستم (کسر مولی یکی از اجزا) میباشد. بنابراین میتوانیم تعادلات فازی سیستم را بر روی نمودار فاز
دما _ ترکیب ترسیم کنیم. یک خط عمودی در چنین نمودار فازی ، سیستمی را با ترکیب یکسان و دماهای مختلف نشان میدهد و
همترکیب نامیده میشود. ( این واژه ، از کلمه یونانی به معنای
مقدار یکسان گرفته شده است.)
نمودارهای فاز مایع _ مایع
ابتدا سیستمهای دو تایی شامل دو مایع با امتزاج پذیری محدود را در نظر میگیریم. دو مایع در چنین سیستمهایی در هر دمایی به هر نسبتی حل نمیشود.
هگزان و
نیترو بنزن یک نمونه از چنین مواردی است. اگر بخواهیم نمودار دما _ ترکیب دو ماده را رسم کنیم، خواهیم دید که دما بر روی ترکیب دو فاز در حال تعادل اثر دارد. در مورد هگزان و نیترو بنزن ، افزایش دما باعث ازدیاد امتزاج پذیری میشود. از آنجایی که در دمای بالاتر ، غلظت حل شوندهها در فازهای در حال تعادل بیشتر میباشد (یعنی فاز غنی نسبت به B ، A بیشتری در خود دارد و فاز غنی نسبت به A ، B بیشتری دارد)، تفاوت ترکیب دو فاز کمتر است. میتوان با تکرار این مشاهدات در دماهای مختلف و رسم منطقه دو فازی ، نمودار فاز را ترسیم کرد.
نمودارهای فاز مایع _ جامد
فازهای جامد و مایع یک سیستم را میتوان در زیر نقطه جوش با یکدیگر نمایش داد. یک نمونه ، دو فلز است که تا نقاط ذوب خوب تقریبا امتزاح ناپذیرند (مانند
آنتیموان و
بیسموت). در رسم این نمودارها به مفاهیم مانند
نقطه اتکتیک بر میخوریم.
سیستمهای سه جزئی
از آنجائی که برای سیستم سه جزئی ،
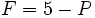
است، واریانس میتواند به 4 هم برسد. با ثابت نگاه داشتن دما و فشار ، دو درجه آزادی دیگر باقی میماند (کسر مولی دو جز) برای نشان دادن چگونگی تغییر تعادلهای فازی با ترکیب سیستم ، مناسبترین روش ، استفاده از
نمودار فاز مثلثی است. نمونهای از یک سیستم سه فازی که میتوان برای آن نمودار مثلثی رسم کرد، ترکیبی از سه مایع با امتزاج پذیری محدود
آب ،
اسید استیک و
کلروفرم است.
مباحث مرتبط با عنوان