تشكيل دوره اول جدول تناوبي
ورود الكترونها در اوربيتالها و تشكيل جدول تناوبي
تاكنون به دانستنيهاي زيادي درباره اوربيتالهاي اتمي و خواص آنها نائل آمده و ميتوانيم از مجموع آنها به گونهاي توصيفي، آرايش الكتروني اتمها را در حالت پايه (برانگيخته نشده) اتم پيشگويي كنيم.
ميدانيم براي بنا نهادن فرضي اتم، بايد به ازاء افزايش هر يك پروتون در هسته، يك الكترون در اوربيتالهاي خارج از هسته وارد كنيم. اين كار بر مبناي يك اصل كلي صورت ميگيرد كه مطابق آن، الكترونها طوري در اوربيتالها قرار ميگيرند، كه مجموع بار الكتريك صفر شود و در هر مورد، اتمي كه داراي پايينترين سطح انرژي و بيشترين پايداري است، پديد آيد.
راه و روشي را كه در پر كردن اوربيتالها دنبال ميكنيم، به وسيله تحليل طيفهاي پيچيده اتمي و محاسبات مربوطه، تأييد ميشود. امّا از آنجا كه بررسي طيفها براي ما، امر دشواري است، تأييد خود را از مجموعه خواص فيزيكي و شيميايي مشهود عناصر وتغييرات تدريجي آنها ميگيريم. در اين بررسيها، خواهيم ديد كه خواص تناوبي مشاهده شده در جدول تناوبي، نتيجهاي منطقي از اصول آرايش يافتن الكترونها در اتم است. به عبارت ديگر، اين نحوه آرايش دادن فرضي الكترونها در اتم كه مبتني بر مطالعات گسترده طيف شناسي و مكانيك كوانتيك است، با همان مبناي ساده تاريخي جدول تناوبي مطابقت ميكند. مبني بر اين است كه " خواص فيزيكي و شيميايي عناصر تابعهاي متناوبي از عدد اتمي آن عناصر هستند." به بيان ديگر، هرگاه عناصر را برحسب افزايش تدريجي عدد اتمي آنها تنظيم كنيم، بسياري از خواص آنها، تغييرات تناوبي داشته و عناصري كه خواص مشابه دارند، در نقاط نسبتاً مشابه قرار ميگيرند.
تشكيل دوره اول جدول تناوبي
نخستين و سادهترين عنصر جدول تناوبي ئيدروژن است. تنها الكترون اتم ئيدروژن در حالت پايه، اوربيتال
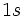
را اشغال ميكند و آرايش الكتروني
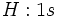
را بوجود ميآورد. عنصر بعدي هليم است. دو الكترون هليم نيز اوربيتال
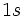
را اشغال ميكنند، كه برحسب اصل پائولي، اسپين آنها مخالف يكديگر است.
برداشتن الكترون از اتم هليم بينهايت مشكل است (انرژي يونيزاسيون هليم از كليه عناصر بيشتر است و مقدار آن به 567 كيلو كالري بر مول ميرسد).
برانگيختن يك الكترون هليم براي رسيدن به نخستين حالت برانگيخته آن، يعني
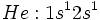
، نيز نياز به انرژي عظيمي دارد. (6/456 كيلوكالري بر مول). به همين دليل ميگوييم كه هليم گازي است نجيب كه تمايل براي شركت در واكنشهاي شيميايي ندارد.
نيروهاي دافعه الكتروستاتيك بين دو الكترون هليم كه در اوربيتال
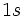
قرار ميگيرند، تراز انرژي را بالا ميبرند. البته نه به اندازهاي كه از لحاظ انرژي به نفع دستگاه باشد كه يك الكترون در اوربيتال
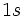
و الكترون ديگر در اوربيتال
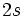
قرار بگيرد. بنابراين، آرايش الكتروني هليم بايد به صورت
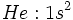
باشد.
از آنجا كه اوربيتال
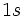
بيش از دو الكترون نميپذيرد، ميگويند كه لايه
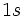
پر شده است و از آنجا كه اين لايه، تنها لايه موجود در سطح اصلي اول (در اينجا عدد كوانتومي اصلي
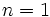
و عدد كوانتومي فرعي
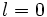
است).
به همين دليل قشر اصلي
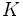
، كاملاً پر شده و به اصطلاح پرونده آن بسته ميشود. بنابراين دوره اول جدول تناوبي فقط شامل دو عنصر ئيدروژن و هليم است.
پیوند های خارجی
http://Olympiad.roshd.ir/chemistry/content/pdf/0146.pdf