اصلاح مدل اتمی بوهر
بسط نظریه بوهر- نظریه اتمی سامرفلد
هر چند که نظریه اتمی بوهر در بسیاری از زمینهها، از جمله تعیین اندازه شعاع، سرعت، انرژی الکترون در ترازهای مجاز، محاسبه طول موج، فرکانس و انرژی مربوط به خطوط طیفی، سریهای متفاوت خطوط طیف نشری اتم هیدروژن و یونهای هیدروژن مانند، از موفقیت کامل برخوردار بود، ولی در برخی از موارد با اشکالاتی مواجه شد.
اولین اشکالی که نظریه بوهر با آن روبرو شد، این بود که بوهر فقط وجود خطوط طیفی منفردی را پیشبینی کرده بود که هر کدام به جهش و سقوط الکترون بین دو سطح انرژی معینی در اتم مربوط میشود. هر چند که در زمان ارائه نظریه وی رویداد دیگری در طیف نشری اتم هیدروژن و یا یونهای هیدروژن- مانند، مشاهده نشده بود، اما با توسعه تکامل دستگاههای طیفنما و افزایش قدرت تشخیص آنها، معلوم شد که این خطوط طیفی منفرد نبوده بلکه غالباً هر یک از آنها، اجتماعی از تعداد معین خطوط بسیار نزدیک به یکدیگرند. این رویداد که چندگانگی خطوط طیفی نامیده شده است، براساس نظریه بوهر قابل توجیه نبود. زیرا، مشاهده این خطوط نزدیک به یکدیگر، نشان میدهد که به جای یک سطح انرژی برای هر عدد کوآنتومی
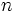
، باید چند سطح انرژی مجاز نزدیک به یکدیگر (سطوح فرعی) در اطراف هسته اتم وجود داشته باشد. به عبارت دیگر، برخلاف آنچه که بوهر پیشبینی کرده بود، انرژی الکترون دقیقاً با در نظر گرفتن یک عدد کوآنتومی
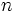
دقیقاً مشخص نمیشود، بلکه برای این منظور باید عدد کوآنتومی دیگری نیز در نظر گرفت تا بتوان براساس آن، انرژی الکترون را در هر یک از سطوح فرعی انرژی مربوط به هر سطح اصلی انرژی، معین کرد. همچنین اگر طیف اتم هیدروژن در میدان مغناطیسی مورد بررسی قرار گیرد طیف پیچیدهتری مشاهده میگردد (اثر زیمان) که مدل بوهر از تفسیر آن عاجز بود.
مسأله چندگانگی خطوط طیفی که براساس مدل اتمی بوهر قابل حل نبود، با پیشنهاد مسیر بیضی شکل برای حرکت الکترون توسط سامرفلد در سال 1915 به روشنی توجیه شد. (البته بوهر قبلاً امکان مسیر بیضی شکل برای حرکت الکترون در اتم را در نظر گرفته بود ولی آن را پیگیری نکرده بود). سامرفلد با بررسی دقیق ویژگیهای مسیرهای بیضی شکل، پیشنهاد کرد که مسیر حرکت الکترون به دور هسته به طور کلی باید به شکل بیضی که هسته در یکی از کانونهای آن قرار دارد، در نظر گرفته شود، تا بتوان مسائل مربوط به انرژی الکترون و چندگانگی خطوط طیفی اتم هیدروژن را توجیه کرد. البته این مسیرها در حالتهای خاصی، مطابق نظریه بوهر میتوانند به شکل دایره باشند.
یک مسئله بزرگ دیگر این بود که نظریه بوهر نمیتوانست مختصات طیفی اتمهای چند الکترونی را به طور کمی و دقیق تفسیر نماید. بنابراین نظریه بوهر- سامرفلد ناکافی بود و جا را برای نظریه کاملتری باز گذاشت. در آن زمان سه تحول علمی همزمان و مهم به وقوع پیوست که عبارتند از: خصلت دوگانه موجی- ذرهای الکترون، اصل عدم قطعیت و معادله موجی شرودینگر.
پیوند های خارجی
http://Olympiad.roshd.ir/chemistry/content/pdf/0600.pdf