قانون اعداد متناسب
قانون اعداد متناسب و یا نسبتهای همارز در یک ترکیب که توسط دالتون بیان شد به شرح زیر است:
دو ماده
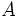
و

را در نظر گرفته (عنصر یا ترکیب) و نیز فرض کنید که
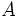
و

میتوانند با هم ترکیب شوند و نیز هر کدام از آنها با یک عنصر یا جسم سومی همانند
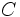
قادرند تولید ترکیبی بنمایند. اگر وزن ثابتی از
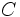
با وزنهای متفاوتی از
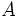
و

ترکیب شود، نسبت وزنی
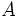
به

معمولاً عددی است غیر کامل، این نسبت را
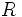
بنامید. موقعی که
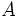
بر روی

تأثیر میگذارد، قانون اعداد متناسب میگوید که نسبت
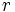
یا وزن
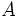
به وزن

برابر است با

که
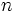
میتواند نسبت ساده و یا عدد کاملی باشد. این قانون را اگر با یک مثال تشریح کنیم درک آن سهلتر خواهد شد:
مثال
اگر نیتروژن

و اکسیژن

با هیدروژن

ترکیب شده و به ترتیب مولکولهای

را به وجود آورند، آنگاه یک گرم هیدروژن با 66/4 گرم نیتروژن تولید آمونیاک و با 8 گرم اکسیژن تولید آب مینماید، بنابراین
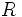
برابر است با:

و از طرف دیگر نیتروژن با اکسیژن طبق واکنش زیر مثلاً تولید گاز
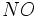
مینماید.
نسبت
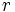
در این مولکول عبارتست از

، بنابر قانون اعداد متناسب:
برای سایر ترکیبات اکسیژنه نیتروژن، ارزش
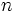
متفاوت است ولی همیشه نسبت آن ساده است. بدین ترتیب قانون اعداد متناسب کمک بزرگی به پیدایش نظریه اتمی ماده نمود، زیرا وزنهای عناصر یا ترکیبات

که با هم ترکیب میشوند. متناسب با جرم مولکولی و یا متناسب با تعداد اتمها و مولکولهای این اجسام است و بنابراین، تعداد مولکولها یا اتمهاست که با نسبتی ساده در ترکیبات وارد میشوند و از آنجا فرضیه وجود جرم اتمی مشخص کننده، بیان گردید و این قانون با روشی خسته کننده ولی ساده وضعیت عمومی ماده و ترکیبات شیمیایی را روشن نمود.
باید توجه داشت که قوانین استوکیومتری برای ترکیباتی که فرمول شیمیایی معینی دارند صادق است. چنین ترکیباتی را ترکیبات استوکیومتری مینامند. در نقطة مقابل، ترکیبات غیر استوکیومتری قرار دارند که فرمول شیمیایی معین با استوکیومتری مشخص ندارند. لذا این قوانین در مورد آنها صدق نخواهد کرد.
پیوند های خارجی
http://Olympiad.roshd.ir/chemistry/content/pdf/0088.pdf