|
|
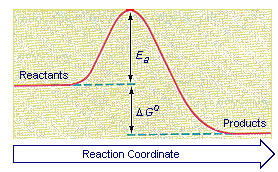
انرژی فعالسازی ، Ea
|
| کمترین مقدار انرژی را که یک برخورد باید فراهم آورد تا واکنش انجام شود، انرژی فعالسازی مینامند. |
سرچشمه انرژی فعالسازی
سرچشمه این انرژی ، همان انرژی جنبشی ذرات در حال حرکت است. بیشتر برخوردها کمتر از این مقدار ، انرژی فراهم میآورند و بیفایدهاند. در این موارد ، ذرات اولیه بطور ساده به عقب میجهند. فقط برخوردهای محکم بین ذراتی که یکی از آنها و یا هر دو با سرعت غیرعادی حرکت میکنند و انرژی کافی در اختیار دارند، موجب اجرای واکنش میشوند. سرانجام ، این برخوردها ، علاوه بر داشتن انرژی به اندازه کافی ، باید هنگامی رخ دهند که ذرات به گونه ای مناسب جهت گرفته باشند.
بررسی یک واکنش برای درک مفهوم انرژی فعالسازی
برای آنکه ببینیم در جریان یک
واکنش شیمیایی ، واقعا چه رخ میدهد، اجازه بدهید به مثال ویژه حمله اتمهای کلر به مولکول متان ، از نزدیک نگاه کنیم:
Cl. + CH3-H -----> H-Cl + .CH3
این واکنش ، بطور نسبی ساده است: در فاز گاز صورت میگیرد و بنابراین ، با حضور حلال پیچیدگی پیدا نمیکند؛ این واکنش ، شامل برهمکنش یک اتم تنها با سادهترین مولکولهای آلی است. ولی از این واکنش ، اصولی را میتوانیم بیاموزیم که در مورد هر واکنشی کاربرد دارند.
|
|
نرژی فعالسازی ، E
|
شرط انجام واکنش
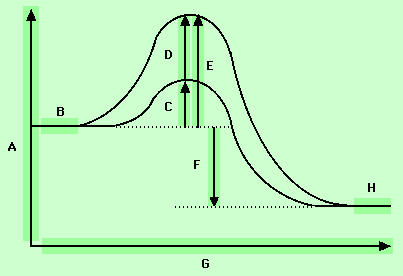
راستی اگر قرار باشد این واکنش انجام شود، چه باید رخ بدهد؟ پیش از هر چیز ، یک اتم
کلر و یک مولکول متان باید برخورد کنند و چون محدوده نیروهای شیمیایی فوقالعاده کوچک است، پیوند هیدروژن- کلر ، فقط هنگامی میتواند تشکیل شود که این اتمها با هم در تماس نزدیک باشند.
بعد برای آنکه این برخورد ، موثر باشد، باید یک مقدار انرژی حداقل داشته باشد. تشکیل شدن پیوند H-Cl ، حدود kcal/mol 103 انرژی آزاد میکند. شکستن پیوند ، انرژی نیاز دارد. ممکن است انتظار داشته باشیم که فقط انرژی اضافی برای اجرای واکنش ، کفایت کند، ولی اینطور نیست. شکستن پیوند و تشکیل شدن پیوند به احتمال قوی در یک زمان انجام نمیشوند و انرژی آزاد شده از یک فرایند ، کاملا در اختیار فرایند دیگر قرار نمیگیرد.
آزمایش نشان داده است که اگر قرار باشد واکنش انجام شود، باید انرژی در اختیار آن قرار داد. همانطور که گفتیم، انرژی فعالسازی ، کمترین مقدار انرژی است که یک برخورد باید فراهم کند تا واکنش انجام شود.
انرژی مورد نیاز واکنش
بطور کلی ، یک واکنش شیمیایی به برخوردهایی با انرژی کافی و جهت گیری مناسب نیاز دارد. تقریبا برای هر واکنشی که در آن پیوندها میشکنند، حتی برای (واکنش گرمازا(واکنشهای گرماده)) که در آنها از تشکیل پیوند ، بیش از آنچه که شکستن پیوند انرژی مصرف میکند، انرژی آزاد میشود، انرژی فعالسازی وجود دارد.
حمله اتمهای
برم به متان ، با تغییر آنتالپی برابر با 16KCal+ خیلی
گرماگیرتر است. شکستن پیوند ، مانند پیش ، به انرژی نیاز دارد که فقط 88KCal آن ، با تشکیل پیوند
H-Br فراهم میآید. آشکار است که حتی اگر این 88KCal بطور کامل برای شکستن پیوند مصرف شود، دستکم 16KCal دیگر باید در اثر برخورد فراهم شود. به عبارت دیگر ، E
act یک
واکنش گرماگیر باید دستکم به بزرگی تغییر آنتالپی باشد. همان طور که E
act> واکنش در مورد بحث (18KCal) ، در واقع بزرگتر از تغییر آنتالپی آن است.
مباحث مرتبط با عنوان
منبع
- شیمی آلی ، جلد 1 ؛ تالیف:موریسون ، بوید ؛ نشر علوم دانشگاهی.