دید کلی
معمولا جزئی از یک محلول را که از لحاظ کمیت بیش از اجزای دیگر است
حلال و سایر اجزای را حل شده (یا حل شونده) میگوییم. اطلاق این اصطلاحات اختیاری است و دقت چندانی ندارد. گاهی آسانتر آن است که جزئی از محلول را با آنکه مقدارش کم است حلال بنامیم و گاهی اصولا اطلاق نام حلال و حل شده به اجزای یک محلول (مثلا محلولهای گازی) چندان اهمیتی ندارد. بعضی از مواد به هر نسبتی در یکدیگر حل میشوند.
امتزاج پذیری کامل از ویژگیهای اجزای تمام محلولهای گازی و بعضی از اجزای محلولهای مایع و جامد است. ولی غالبا ، مقدار مادهای که در حلال معینی حل میشود، محدود است. انحلال پذیری یک ماده در یک حلال مخصوص و در دمای معین ، بیشترین مقداری از آن ماده است که در مقدار معینی از آن حلال حل میشود و یک سیستم پایدار بوجود میآورد.
چگونگی انحلال مواد
میان مولکولهای کووالانسی غیر قطبی ، تنها نیروهای بین مولکولی موجود ،
نیروهای لاندن است. ولی نیروهای جاذبه بین مولکولهای کووالانسی قطبی علاوه بر
نیروهای لاندن ، نیروهای دوقطبی - دوقطبی را نیز شامل میشود. در مواردی که
پیوند هیدروژنی وجود دارد نیروهای بین مولکولی بطور غیر عادی قوی است. مواد قطبی و مواد غیر قطبی معمولا امتزاج ناپذیرند. مثلا
تتراکلرید کربن (یک ماده ناقطبی) در آب (یک ماده قطبی) نامحلول است. زیرا نیروی جاذبه یک مولکول آب نسبت به یک مولکول دیگر آب قویتر از نیروی جاذبه بین مولکول تتراکلرید کربن و یک مولکول آب است. از اینرو ، مولکولهای تتراکلرید کربن رانده میشوند و این دو ماده یک سیستم مایع دو لایهای تشکیل میدهند.
انحلال ید در کربن تتراکلرید
ید که یک ماده غیرقطبی است، در تتراکلرید کربن حل میشود. نیروی جاذبه بین مولکولهای

در ید جامد ، تقریبا از همان نوع و اندازهای است که بین مولکولهای

در تتراکلرید کربن خالص وجود دارد. از اینرو ، جاذبهای قابل توجه بین ید و کربن تتراکلرید ممکن میگردد و مولکولهای ید میتوانند با مولکولهای تتراکلرید کربن ممزوج شوند و محلول حاصل یک مخلوط مولکولی بینظم است.
انحلال متیل الکل
متیل الکل
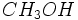
مانند آب ، شامل مولکولهای قطبی است که بسیار بهم پیوستهاند. در هر دو مایع خالص ، مولکولها بوسیله پیوند هیدروژنی به یکدیگر جذب میشوند. متیل الکل و آب به هر نسبت در یکدیگر حل میشوند. در محلول متیل الکل در آب ، مولکولهای
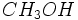
و
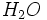
با پیوند هیدروژنی بهم پیوستهاند. متیل الکل در حلالهای غیر قطبی حل نمیشود. نیروهای جاذبه قوی بین مولکولی در متیل الکل خالص مغلوب نمیشوند، مگر آنکه نیروهای جاذبهای که بین مولکولهای حلال و مولکولهای متیل الکل بوجود میآید برابر یا تقریبا برابر با نیروهای جاذبه بین مولکولهای متیل الکل باشد.
نخستین قاعده انحلال پذیری
بطور کلی ، مواد قطبی فقط در حلالهای قطبی و مواد غیر قطبی حل میشوند. نخستین قاعده انحلال پذیری این است که
نظیر در نظیر حل می شود. بلورهای مشبک مثل
الماس که در آنها اتمهای تشکیل دهنده بلور با
پیوندهای کوالانسی به یکدیگر پیوستهاند، در تمام مایعات نامحلولاند. این
ساختار بلورین بسیار ناپایدارتر از آن است که با فرآیند انحلال از بگسلد. هیچ جاذبه بالقوه بین
حلال -
حل شونده نمیتواند به قدرت پیوند کوالانسی موجود در این نوع بلور برسد.
مایعات قطبی
مایعات قطبی (بویژه آب) می توانند حلال بسیاری از ترکیبات یونی باشند. یونهای مواد حل شونده توسط مولکولهای حلال قطبی با
نیروهای الکتروستاتیکی جذب می شوند، یعنی یونهای منفی توسط قطبهای مثبت مولکولهای حلال و یونهای مثبت توسط قطبهای منفی این مولکولها جذب میشوند. این جاذبههای یون - دوقطبی ممکن است نیروهایی نسبتا قوی باشند.
چگونگی انحلال یک بلور یونی در آب
یونهایی که در مرکز یک
بلور یونی قرار دارند، توسط یونهایی از بلور که بار مخالف دارند، بطور مساوی در تمام جهات کشیده میشوند. ولی نیروهای جاذبه الکتروستاتیکی بر یونهایی که در سطح بلور قرار دارند، نامتوازناند. مولکولهای آب بسوی این یونهای سطحی جذب میشوند، یعنی سر مثبت مولکولهای آب بسوی
آنیونها و سر منفی این مولکولها بسوی
کاتیونها جذب میشوند. جاذبههای یون - دو قطبی که به این طریق بوجود میآید، موجب میشود که یونها از بلور جدا شده و در فاز مایع شناور شوند. یونهای حل شده آب پوشیدهاند و در حالی که با غلافی از مولکولهای آب احاطه شدهاند در محلول حرکت میکنند. تمام یونها در محلول آبی آب پوشیدهاند.
مباحث مرتبط با عنوان