تشكيل دوره پنجم جدول تناوبي
اين دوره نيز مانند دوره چهارم شامل 18 عنصر است كه با فلز قليايي روبيديم

آغاز ميگردد و با گاز نجيب زنون

خاتمه مييابد. بنابراين مانند دوره چهارم، عنصر اول و دوم از وارد شدن الكترونها در اوربيتال

پديد ميآيند. سپس 10 عنصر فلزي معروف به سري دوم عناصر واسطه، از وارد شدن الكترونها در 5 اوربيتال

بدست ميآيند. بالاخره 6 عنصر غير فلزي نيز از وارد شدن الكترونها در سه اوربيتال

بوجود ميآيند.
كيفيت پر شدن اوربيتالهاي

و شرايط تغيير انرژي در آنها، كم و بيش با روندهاي ديده شده در

مشابه است. يك تفاوت محسوس آن است كه طرحهاي مشابه كروم و مس در اين سري از عناصر واسطه بيشتر است. به عبارت ديگر، آرايش

بيشتر به چشم ميخورد. اين پديده نشانهاي از پايداري نسبي بيشتر در اوربيتالهاي

حكايت ميكند كه ممكن است انعكاسي از نفوذ پذيري بيشتر اين اوربيتالها نسبت به اوربيتالهاي

باشد. يك دليل منطقيتر براي پايداري قابل توجه اوربيتالهاي

آن است كه اثر پوششي اوربيتالهاي

كه زير آنها قرار دارند، كم است. به همين دليل و بعد از وارد شدن 2 پروتون در هسته استرانسيم، اوربيتالهاي
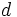
شديداً تحت تأثير اثر جذب اضافي هسته قرار گرفته و افت بزرگي در تراز انرژي آنها روي ميدهد. اين افت به اندازهاي زياد است كه از تراز

، عنصر
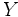
به عنوان نخستين عنصر واسطه دوره پنجم متولد ميشود.
دو فلز معروفتر در اين سري از عناصر واسطه
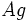
، با آرايش

و

، با آرايش

ميباشند كه كم و بيش نظير فلزهاي مس و روي در سري قبل هستند. يك تفاوت محسوس ميان مس و نقره آن است كه لايه

در طرح ساختماني

وابسته به مس راحتتر درهم ميشكند بطوريكه مس دو ظرفيتي با آرايش

پديد ميآيد. در صورتي كه در هم شكستن لايه

در نقره مشكل است و رسيدن به ظرفيت +2 براي آن دشوار ميباشد. از نظر خواص شيميايي، لايه پر

در كادميم مانند لايه پر

در روي، جزئي از قشر مياني محسوب ميشود و ديگر در واكنشهاي شيميايي شركت نميكند.
پس از كادميم نوبت پر شدن لايه

سر ميرسد و در پايان دوره بلند دوم، به گاز نجيب زنون ميرسيم.
انرژي يونيزاسيون گاز زنون 280 كيلوكالري بر مول است كه رقم فوقالعاده بالايي به شمار نميرود و اين خود دليلي براي امكان شركت اين عنصر در برخي واكنشهاي شيميايي را مطرح ميكند. زنون نخستين گاز نجيبي بود كه در تشكيل برخي تركيبها از قبيل

شركت كرد.
پیوند های خارجی
http://Olympiad.roshd.ir/chemistry/content/pdf/0152.pdf