دید کلی
بسیاری از
واکنشهای شیمیایی با آزاد کردن
انرژی همراه هستند. این انرژی آزاد شده میتواند بصورت
گرما ،
نور یا صدا باشد. چنین واکنشهایی را واکنش گرماده میگویند. روزانه از واکنشهای گرماده زیادی برای منظورهای مختلف استفاده میکنیم. سادهترین این واکنشها روشن کردن کبریت است که واکنشی بین اکسیژن هوا و ماده آتشگیر آن رخ میدهد که با آزاد کردن نور و گرما همراه است.
سوختهای طبیعی ترکیبات پیچیدهای از
کربن و
هیدروژن هستند. وقتی که این مواد در
اکسیژن میسوزند
دیاکسید کربن ،
آب و حرارت ایجاد میکنند.
برخی از
سوختها مانند هیدروژن و
مواد منفجره مانند TNT و
دینامیتها در اثر واکنش ظرفیتهای بالایی از انرژی را در مدت زمان کوتاهی آزاد میکنند، بنابراین انفجار را میتوان واکنش گرماده در نظر گرفت که انرژی زیادی را بصورت گرما ، صدا و نور در زمان کمتری آزاد میکند.
انجام واکنش گرماده از لحاظ تئوری
طبق
قانون بقای انرژی ، انرژی از بین نمیرود اما بصورتهای دیگر تبدیل میشود، بنابراین انرژی یک سیستم مقدار ثابتی است. بعنوان مثال انرژی امروزی جهان با انرژی آن در هزاران سال پیش برابر است. واکنشهای شیمیایی با تغییر انرژی همراهاند. در یک واکنش وقتی پیوندهای ناپایدار با پیوندهای پایدارتری جایگزین میشوند مقداری انرژی آزاد میشود، بنابراین تشکیل پیوندهای پایدار با آزاد کردن انرژی همراه است و وقتی میلیونها پیوند پایدار در یک واکنش ایجاد میشود این انرژیها با هم جمع شده و انرژی بالایی را بصورت
حرارت ، نور یا انفجار آزاد میکنند.
بنابراین در یک واکنش گرماده سطح انرژی کمتر از سطح انرژی مواد واکنش دهنده است و گرمای آزاد شده را با
آنتالپی منفی نمایش میدهند.
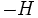
وقوع واکنشهای گرماده از لحاظ ترمودینامیکی
برخی از واکنشهای شیمیایی گرماده بصورت خود بخودی انجام میگیرند. میزان خود بخودی بودن یک واکنش را ΔG که معیاری از آنتروپی و محتوای آنتالپی است، مشخص میکند. اما پیشگویی خود بخودی بودن یک واکنش دلیل بر وقوع آن واکنش نیست. زیرا ترمودینامیک ، چیزی در مورد سرعت یک واکنش پیشبینی نمیکند. بعنوان مثال واکنش کربن با اکسیژن در دمای 25ْ و فشار 1 atm از لحاظ ترمودینامیکی قابل انجام است. اما بدون یک عامل موثر مثل حرارت ممکن است مخلوط کربن و
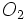
مدتهای مدیدی بدون تغییر باقی بماند.
تغییر آنتروپی یک محیط بر اثر گرمایی که بعلت تغییر آنتالپی واکنش به محیط یا از محیط منتقل میشود بوقوع میپیوندد. هر چه
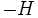
بزرگتر باشد بینظمی بیشتری در محیط ایجاد میشود.
پس در یک واکنش گرماده خود بخودی:
ΔG = ΔH -TΔs < 0
0> ΔH در یک واکنش گرمازا
Δs > 0 میزان بینظمی در یک واکنش خود بخودی
پس T.Δs > 0
آنگاه
TΔs < 0- است. چون
Δs برای یک تغییر خود بخود بزرگتر از صفر است و
TΔs کل هم باید بزرگتر از صفر باشد در اینصورت

بوده برای یک تغییر خود بخود
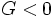
است. برای بسیاری از واکنشهای شیمیایی در 25 درجه سانتیگراد و فشار 1atm مقدار مطلق
ΔH بسیار بزرگتر از مقدار
TΔs میباشد در این شرایط واکنشهای گرمازا بصورت خود بخود صورت میگیرند.
استفاده از واکنشهای گرمازا در صنعت
بیشتر کورههای احتراقی که عملیات گداختن و تصفیه کانی
آهن و تولید آهن در آنها انجام میگیرد نیاز به دماهای بسیار بالا برای انجام واکنش دارند. در عملیات ذوب سنگ آهن ، سنگ آهن را با کک و سنگ آهک در کوره قرار داده و جریانی از هوای داغ را به درون کوره هدایت میکنند. واکنش کک ( کربن ) با اکسیژن بسیار گرمازا است. بنابراین این کورهها را از اکسیژن غنی میکنند. کک در اثر گرما هوای داغ با اکسیژن وارد واکنش شده و
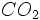
ایجاد میکند که از گرمای فراوان حاصل از این واکنش برای
ذوب سنگ آهن استفاده میشود.
مباحث مرتبط با عنوان