| دو ترکیب که فرمول مولکولی یکسان ولی آرایش اتمی متفاوت داشته باشد ایزومر نامیده میشوند. به عبارتی ترکیباتی که دارای فرمولهای بسته مشابه ولی فرمولهای گسترده متفاوت باشند را ایزومری میگویند. چنین ترکیباتی در خواص شیمیایی و فیزیکی باهم فرق دارند. این کلمه از واژه یونانی isos به اضافه meros به معنای (ساخته شده از بخشهای یکسان ) گرفته شده است. |
ریشه لغوی
واژه ایزومری اولین بار به توسط
برزلیوس (J.J.Berzelius) برای معرفی ترکیبات شیمیایی گوناگون دارای ترکیب درصد عناصر یکسان ، به عبارت دیگر تناسبهای نسبی یکسان عناصر سازنده ، مورد استفاده واقع شد. این احتمال که یکسانی ترکیب درصد عناصر سازنده بتواند دلالت بر وجود دو یا چند ماده به عنوان ایزومرهای یکدیگر نماید، از تئوری ساختمانهای آلی مشتق شده است. در حالت کلی ، میتوان ایزومرها را به دو نوع
ایزومری ساختمانی و
ایزومری فضایی تقسیم بندی نمود. که هر کدام از این ایزومرها دارای انواع مختلف میباشند.
ایزومری ساختمانی
ایزومری ساختمانی بوسیله ترکیباتی که در
فضای کوئوردیناسیون خود لیگاندهای متفاوتی دارند نمایش داده میشود. و انوع زیرا را در بر میگیرد:
ایزومری یونش
در این نوع ایزومری ،
یون یا یونهایی که در یک ایزومر در کره کوئوردیناسیون خارجی قرار دارند، در ایزومر دیگر در نقش لیگاند در کره کوئوردیناسیون داخلی وارد میشود و در ترکیبهایی که
آنیون در ساختار داخلی و خارجی کره کوئوردیناسیون شرکت دارد مشاهده میشود.
pt(NH3)3Cl) I ↔ (pt(NH3)3I) Cl)
ایزومری هیدراته شدن
مولکول آب در ترکیب کوئوردیناسیون ممکن است مستقیما با
فلز پیوند داشته باشد یا در کره کوئوردیناسیون خارجی به عنوان
آب تبلور شرکت کند. ترکیبهایی که بر اساس این تفاوت دسته بندی میشوند، ایزومرهای هیدرات (
هیدراتاسیون) نامیده میشوند و دارای خواص فیزیکی و شیمیایی متفاوتی هستند.
CO(NH3)3(H2O)2 Cl ↔ (CO(NH3)3(H2O) Cl Br) Br.H2O
ایزومری کوئوردیناسیون
در ترکیبات یونی که هم کاتیون و هم آنیون آنها
کمپلکس مشاهده میشود و تفاوت آنها در توزیع لیگاندها اطراف اتمهای مرکزی است. این دو ایزومر در اثر تعویض لیگاندها اتم مرکزی بوجود میآید.
Cu(NH
3)
4 PtCl
4 ↔ Pt(NH
3)
4 CuCl
4 ↔ Pt(NH
3)
3Cl Cu(NH
3)Cl
3
ایزومری اتصال
این ایزومرها به خانوادههای متفاوتی از ترکیبات آلی مربوط میشوند که تنها فرمولهای مولکولی مشابه دارند. بطور مثال
الکل 
و
اتر 
با هم ایزومر گروه عاملی هستند. در ترکیبهایی دیده میشود که یک یا چند لیگاند دارای دو اتم کوئوردیناسیون دهنده باشند، برای مثال یون نیتریک NO
-2 میتواند از طریق یک اتم اکسیژن یا از طریق اتم نیتروژن کوئوردیناسیون بدهد.
زرد NH
3)
5CO(NO
2)) Cl
2)) و قرمز NH
3)
5-CO-ONO) Cl
2))
ایزومری فضایی
شامل ایزومری هندسی و نوری میباشد.
ایزومری هندسی
ترکیبات وقتی ایزومرهای فضایی یکدیگرند که در فضای کوئوردیناسیون خود لیگاندها یا گروههای یکسان داشته باشند ولی نحوه آرایش آنها در فضا متفاوت باشد. یک نوع این ایزومر فضایی ،
ایزومری هندسی ، یا
ایزومری سیس- ترانس ، است. در
آلکنها ، وقتی گروههای مشابه در یک طرف
پیوند دوگانه باشند، ایزومر سیس و اگر در دو طرف پیوند دوگانه باشند، ایزومر ترانس است. اگر دو گروه مشابه به یک کربن آلکن متصل باشد، ایزومری سیس و ترانس وجود ندارد. اما اگر گروههای مختلف به کربنهای پیوند دوگانه متصل باشند، ایزومری هندسی دیده میشود.
اگر در آلکنها ، فقط یک اتم هیدروژن و سه عامل جانشینی دیگر داشته باشیم، بجای سیس و ترانس از سیستم Z و E استفاده میکنیم. روی کربن متصل به پیوند دوگانه دو گروه وجود دارد یکی از این دو گروه بر دیگری ارجحیت دارد. آن گروه را مشخص میکنیم. مشخص کردن آنها به عدد اتمی عنصر متصل به کربن بستگی دارد که هر چه بیشتر باشد، ارجحیت بیشتری دارد. در مورد ترکیبات کوئوردیناسیون ، این نوع ایزومری در اثر اشغال موقعیتهای مختلف در اطراف اتم مرکزی توسط لیگاند بوجود میآید و در گونههای مسطح مربعی و هشت وجهی اهمیت بیشتری دارد. برای مثال در ایزومر سیس- دی کلرو دی آمین پلاتین (II) اتمهای کلر روی گوشههای مجاور مربع (در امتداد یک ضلع) واقع شدهاند، در حالیکه در ایزومر ترانس ، اتمهای کلر گوشههای مقابل دور امتداد را اشغال میکنند. مثلا برای ترکیب
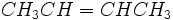
دو فرمول گسترده فضایی میتوان نوشت:
ایزومری نوری
نوع دیگری ایزومر فضایی ،
ایزومری نوری است. پارهای از مولکولها و یونها در دو شکل که قابل انطباق بر یکدیگر نیستند، رابطه بین آنها مثل رابطه دستهای راست و چپ است وجود دارند و از چنین مولکولها و یونهایی به عنوان نامتقارن یاد میشود و این ایزمرها را
انانتیومر (تصویر آینهای) مینامند. این ایزومرها دارای خواص فیزیکی یکسان میباشند و تنها تفاوت ایزومرهای نوری تاثیر بر
نور قطبی شده است.
این نوع ایزومری در
مولکولهای کایرال وجود دارد. اگر دو ترکیب از هر لحاظ با هم مشابه باشند بر یکدیگر منطبق میشوند در حالیکه یک مولکول کایرال ممکن است دارای یک
ایزومر فضایی باشد که بر تصویر آینهاش منطبق نیست (انانتیومر). تفاوت چنین ایزومرهایی مانند اختلاف دست چپ و راست است. ایزومر راست گردان (d) نور قطبی شده (نوری که در یک صفحه نوسان میکند) را به راست و ایزومر چپ گردان (L) آن به چپ میچرخاند. مخلوط مساوی از دو ایزومر را
اسمیک مینامند، اثری بر نور قطبی شده ندارد.
مباحث مرتبط با عنوان